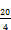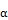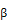Anlage 9
II. NACHWEIS UND HALBQUANTITATIVE BESTIMMUNG VON OXIDIERENDEN FARBSTOFFEN IN HAARFÄRBEMITTELN
- 1. ZWECK UND ANWENDUNGSBEREICH
Nach dieser Methode lassen sich nachstehend aufgeführte Substanzen in cremeförmigen und flüssigen Haarfärbemitteln nachweisen und halbquantitativ bestimmen:
Bezeichnung der Substanzen | Symbol |
Phenylendiamine | |
1-2 Phenylendiamin (o) | (OPD) |
1-3 Phenylendiamin (m) | (MPD) |
1-4 Phenylendiamin (p) | (PPD) |
Toluylendiamine | |
3-4 Toluylendiamin (o) | (OTD) |
2-4 Toluylendiamin (m) | (MTD) |
2-5 Toluylendiamin (p) | (PTD) |
Diaminophenol | |
2-4 Diaminophenol | (DAP) |
Hydrochinon | |
1-4 Dihydroxybenzol | (H) |
a-Naphthol | (N) |
Pyrogallol | |
1-2-3 Trihydroxybenzol | (P) |
Resorcin | |
1-3 Dihydroxybenzol | (R) |
- 2. PRINZIP
Die oxidierenden Farbstoffe werden den cremeförmigen oder flüssigen Färbemitteln bei einem pH-Wert von 10 mit Hilfe von 96 %igem Äthanol entzogen und dünnschichtchromatographisch (eindimensional (5) und/oder zweidimensional (6)) identifiziert.
Zur halbquantitativen Bestimmung der Substanzen vergleicht man das chromatographische Bild der Proben unter Anwendung von vier Entwicklungssystemen mit denjenigen der Lösungen der chromatographisch bestimmten Vergleichserzeugnisse.
- 3. REAGENZIEN
Es sind ausschließlich analysenreine Reagenzien zu verwenden.
- 3.1. absolutes Äthanol
- 3.2. Aceton
- 3.3. Äthanol 96° (v/v)
- 3.4. 25 %iges Ammoniak
- 3.5. L(+)-Ascorbinsäure
- 3.6. Chloroform
- 3.7. Cyclohexan
- 3.8. technischer Stickstoff
- 3.9. Toluol
- 3.10. Benzol
- 3.11. primäres Butanol
- 3.12. sekundäres Butanol
- 3.13. 50 %ige unterphosphorige Säure
- 3.14. Diazoreagenzien: hier können verwendet werden
- 4-Nitro-1-benzoldiazon, versalzen und stabilisiert durch (beispielsweise) Chlorbenzolsulfonat-Ion (rouge 2 JN von Francolor oder ähnliches),
- 2-Chloro-4nitro-1-benzoldiazon, versalzen und stabilisiert durch (beispielsweise) Naphthalinbenzoat-Ion (NNCD Reagens – Nr. 74150 von Fluka oder ähnliches).
- 3.15. Silbernitrat
- 3.16. p-Dimethylaminobenzaldehyd
- 3.17. 2-5-Dimethylphenol
- 3.18. Ferrochlorid 6 H2O
- 3.19. 10 %ige Salzsäure
- 3.20. Vergleichssubstanzen
Als Vergleichssubstanzen dienen die im Abschnitt 1 „Zweck und Anwendungsbereich“ aufgeführten Stoffe. Amino-Verbindungen sind ausschließlich als Mono- oder Bi-Chlorhydrate oder in basischer Form zu verwenden.
- 3.21. Vergleichslösungen (0,5 % m/v)
Von jeder der in 3.20 genannten Vergleichssubstanzen wird eine 0,5 %ige (m/v) Lösung hergestellt.
50 mg
1 mg der Vergleichssubstanz werden in einen 10-ml-Meßkolben eingewogen.
5 ml 96 %iges Äthanol hinzugeben (3.3).
250 mg Ascorbinsäure hinzugeben (3.5).
Die Mischung mit Hilfe einer Ammoniaklösung (3.4) auf einen pH-Wert von 10 bringen.
Mit 96 %igem Äthanol auf 10 ml auffüllen und mischen.
Die Lösungen können eine Woche lang an einem kühlen, lichtgeschützten Ort aufbewahrt werden.
Bei der Zugabe der Ascorbinsäure und des Ammoniaks kann sich in bestimmten Fällen ein Niederschlag bilden. In diesem Fall empfiehlt sich vor der Probenahme eine Dekantierung.
- 3.22. Laufmittel
- 3.22.1. Aceton – Chloroform – Toluol: 35-25-40 (v/v/v)
- 3.22.2. Chloroform – Cyclohexan – Absolutes Äthanol – 25 %iges Ammoniak: 80-10-10-1 (v/v/v/v)
- 3.22.3 Benzol – Sekundäres Butanol – Wasser: 50-25-25 (v/v/v). Die Mischung gut schütteln und nach Dekantierung bei Raumtemperatur (20 – 25 °C) die oberste Phase abnehmen.
- 3.22.4. Primäres Butanol – Chloroform und Reagens M: 7-70-23 (v/v/v). Bei 20 bis 25 °C sorgfältig dekantieren und die untere Phase verwenden.
Vorbereitung des Reagens M
25 %ige NH4OH (v/v) (3.4) | 24 Teile |
50 %ige unterphosphorige Säure (3.13) | 1 Teil |
H2O | 75 Teile |
Anmerkung
Laufmittel, die Ammoniak enthalten, müssen vor ihrer Verwendung gut geschüttelt werden.
- 3.23. Nachweismittel
- 3.23.1. Diazoreagens
Eine 5 %ige wäßrige Lösung (m/v) des Reagens (3.14) herstellen. Diese Lösung muß unmittelbar vor ihrer Verwendung hergestellt werden.
- 3.23.2. Reagens nach Ehrlich
2 g p-Dimethylaminobenzaldehyd (3.16) in 100 ml 10 %iger wäßriger Salzsäure (m/v) auflösen (3.19).
- 3.23.3. 2-5-Dimethylphenol-Ferrochlorid 6 H2O
Lösung 1: 1 g Dimethylphenol (3.17) in 100 ml 96 %igem Äthanol auflösen (3.3).
Lösung 2: 4 g Ferrochlorid 6 H2O (3.18) in 100 ml 96 %igem Äthanol auflösen (3.3).
Bei Durchführung des Nachweises die beiden Lösungen einzeln aufsprühen, und zwar zunächst Lösung 1 und dann Lösung 2.
- 3.23.4. Ammoniakalisches Silbernitrat
Einer 5 %igen wäßrigen Lösung (m/v) von Silbernitrat (3.15) 25 %iges Ammoniak (3.4) zusetzen, bis sich der Niederschlag auflöst.
Dieses Reagens ist unmittelbar vor seiner Verwendung herzustellen. Nicht aufbewahren!
- 4. GERÄTE
- 4.1. Laboratoriumsausrüstung für Dünnschichtchromatographie
- 4.1.1. Kunststoff- oder Glasschale, in der die chromatographische Platte während der Absitzung und bis zur Ausentwicklung unter Stickstoff gehalten werden kann. Diese Vorsichtsmaßnahme ist wegen der starken Oxidierbarkeit bestimmter Farbstoffe notwendig.
- 4.1.2. 10-
l-Spritze (0,2-l-Einteilung) mit Nadel (gerades Ende) oder vorzugsweise ein automatisches Auftraggerät (50
l), derart am Stativ befestigt, daß die Platte unter Stickstoff gehalten werden kann.
- 4.1.3. Kieselgel-Fertigplatten von 0,25 mm Dicke auf Kunststoffilm 20 = 20 cm (Macherey und Nagel Kieselgel G-HR oder ähnliches).
- 4.2. Zentrifuge 4 000 U/min.
- 4.3. Zentrifugierröhrchen 10 ml mit Schraubverschluß.
- 5. ARBEITSWEISE
- 5.1. Vorbehandlung der Proben
Die aus der Tubenöffnung austretenden ersten 2 oder 3 cm Creme werden entfernt.
In ein vorher mit Stickstoff durchspültes Zentrifugierröhrchen (4.3) werden 300 mg Ascorbinsäure, 6 g Creme oder 3 g homogenisierte Flüssigkeit gegeben.
Liegt der pH-Wert unter 10, so werden einige Tropfen des 25%igen Ammoniaks hinzugefügt und das Zentrifugierröhrchen mit 96%igem Äthanol (3.3) auf 10 ml aufgefüllt.
Unter Stickstoff homogenisieren, das Röhrchen verschließen und 10 Minuten lang bei 4 000 U/min. zentrifugieren.
Die obenschwimmende Lösung verwenden.
- 5.2. Chromatographie
- 5.2.1. Auftragen
Unter Stickstoff auf eine Kieselgelplatte (4.1.3) an neun Punkten 1
l von jeder der beschriebenen Vergleichslösungen auftragen. Diese werden wie folgt verteilt:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
R | P | H | PPD | DAP | PTD | OPD | OTD | MPD |
MTD | alpha-N | |||||||
Außerdem werden jeweils am 10. und am 11. Punkt 2 
Die Platte bis zur chromatographischen Trennung unter Stickstoff aufbewahren.
- 5.2.2. Entwicklung
Die Platte wird in einen vorher mit Stickstoff gereinigten und mit den Dämpfen eines der vier geeigneten Lösungsmittel (3.22) gesättigten Behälter eingehängt und bei Raumtemperatur und Dunkelheit so lange entwickelt, bis sich die Lösungsmittelfront etwa 15 cm vom Startpunkt entfernt hat.
Nunmehr die Platte herausnehmen und unter Stickstoff bei Raumtemperatur trocknen.
- 5.2.3. Nachweis
Die Platte mit einem der in 3.23 genannten vier Nachweismittel besprühen.
- 5.2.4. Identitätsprüfung
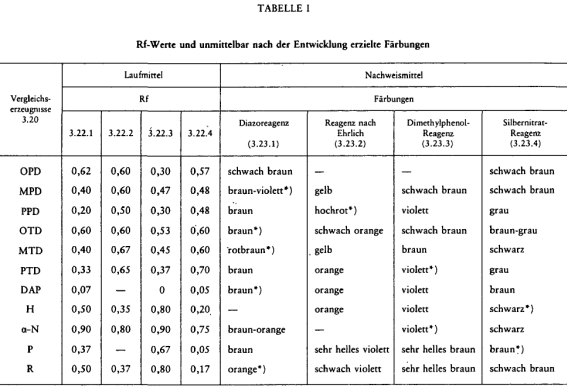
Man vergleicht die Rf und die an jeder Probe erhaltenen Färbungen mit denen der Vergleichssubstanzen. In Tabelle I sind die Rf und Färbungen angegeben, wie sie mit den einzelnen Lauf- und Nachweismitteln für jede Probe erzielt wurden.
Läßt die Identitätsprüfung Zweifel aufkommen, so kann zuweilen dadurch Klarheit erzielt werden, daß man der Probe die entsprechende Vergleichssubstanz hinzufügt.
- 5.2.5. Halbquantitative Bestimmung
Man vergleicht visuell die Intensität der Flecken der einzelnen nach 5.2.4 nachgewiesenen Substanzen mit einer geeigneten und bekannten anhand der entsprechenden Vergleichssubstanz gewonnenen Standardkonzentration.
Ist die Konzentration des Bestandteils der Probe zu hoch, so muß die zu chromatographierende Lösung verdünnt und eine neue Bestimmung vorgenommen werden.
Anmerkungen:
- 1. OPD wurde nur schwach sichtbar, für eine deutliche Trennung von OTD muß das Lösungsmittel (3.22.3) verwendet werden.
- 2. *) zeigt den besten Nachweis an.
- 6. ZWEIDIMENSIONALE DÜNNSCHICHTCHROMATOGRAPHISCHE UNTERSUCHUNG
Zu der hier beschriebenen zweidimensionalen Dünnschichtchromatographie werden nachstehende Reagenzien gebraucht:
- 6.1. Vergleichssubstanzen und -lösungen
- 6.1.1.
-Naphthol (
-N)
- 6.1.2. 2-Aminophenol (OAP)
- 6.1.3. 3-Aminophenol (MAP)
- 6.1.4. 4-Aminophenol (PAP)
- 6.1.5. 2-Nitro-p-Phenylendiamin (2 NPPD)
- 6.1.6. 4-Nitro-o-Phenylendiamin (4 NOPD)
Von diesen zusätzlichen Vergleichssubstanzen wird eine 0,5 %ige Lösung (m/v) nach 3.2.1 hergestellt.
- 6.2. Laufmittel
- 6.2.1. 25%iges Äthylacetat-Cyclohexan-Ammoniak (65-35-0,50) (v/v/v)
- 6.3. Nachweismittel
Ein Glasgefäß in einen Entwicklungsbehälter für Dünnschichtchromatographie bringen, etwa 2 g kristallisiertes Jod hineingeben und den Behälter schließen.
- 6.4. Chromatographie
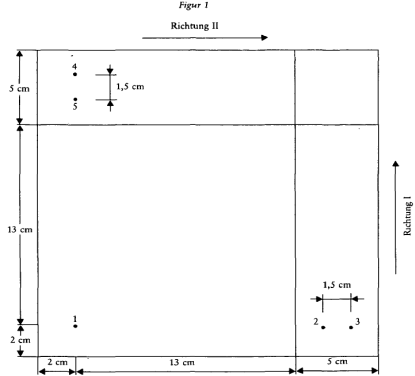
- 6.4.1. Wie auf Figur 1 angegeben, zwei Linien auf der Adsorptionsschicht einer dünnschichtchromatographischen Platte einzeichnen (4.1.3).
- 6.4.2. Unter Stickstoff (4.1.1) auf den Startpunkt 1 (Figur 1) bis 4
l Extrakt (5.1) auftragen. Die Menge hängt von der Intensität der auf dem Chromatogramm (5.2) erhaltenen Flecken ab.
- 6.4.3. Die nachgewiesenen beziehungsweise nach Punkt 5.2 vermeintlich nachgewiesenen oxidierenden Farbstoffe je zur Hälfte auf die Punkte 2 und 3 (Figur 1) auftragen. Der Abstand zwischen diesen Punkten beträgt 1,5 cm. Von sämtlichen Referenzlösungen mit Ausnahme von DAP 2
l auftragen, von DAP werden 6
l benötigt. Dies muß in Stickstoffatmosphäre geschehen.
- 6.4.4. Den unter 6.4.3 beschriebenen Vorgang bei den Startpunkten 4 und 5 (Figur 1) wiederholen und die Platte bis zur Durchführung der Chromatographie in Stickstoffatmosphäre aufbewahren.
- 6.4.5. Einen Chromatographierbehälter mit Stickstoff durchblasen und eine geeignete Menge Entwicklungslösung (3.22.2) einfüllen. Die Platte (6.4.4) in den Behälter stellen und bei Dunkelheit in der ersten Laufrichtung chromatographieren (Figur 1). Solange chromatographieren bis die Lösungsmittelfront mindestens 13 cm durchlaufen hat.
- 6.4.6. Die Platte aus dem Behälter nehmen und zur Verdampfung der Lösungsmittelreste wenigstens 60 Minuten lang in den mit Stickstoff ausgeblasenen Behälter legen.
- 6.4.7. Mit einem mit Meßskala versehenen Reagenzglas eine geeignete Menge des Laufmittels (6.2.1) in einem mit Stickstoff ausgeblasenen Behälter eingeben, dann die im Verhältnis zur ersten Elutionsrichtung um 90° gedrehte Platte in den Behälter einsetzen und in der zweiten Richtung bei Dunkelheit chromatographieren, bis die Lösungsmittelfront die auf der absorbierenden Schicht markierte Linie erreicht. Die Platte aus dem Behälter nehmen und das Lösungsmittel an der Luft verdampfen lassen.
- 6.4.8. Die Platte 10 Minuten lang in einem Chromatographierbehälter Joddämpfen (6.3) aussetzen und das zweidimensionale Chromatogramm anhand der zur gleichen Zeit chromatographierten Vergleichssubstanzen auswerten (Tabelle II).
Anmerkung
Die intensivste Färbung der Flecken erhält man, wenn man das Chromatogramm eine halbe Stunde lang nach der Entwicklung der Luft aussetzt.
- 6.4.9. Der Nachweis der nach 6.4.8 gefundenen oxidierenden Farbstoffe läßt sich zweifelsfrei dadurch erbringen, daß man die in 6.4.1 bis 6.4.8 einschließlich beschriebene Behandlung wiederholt, wobei man auf den Startpunkt 1 neben die in 6.4.2 vorgeschriebene Extraktmenge 1
l der in 6.4.8 nachgewiesenen Vergleichssubstanz aufbringt.
Läßt sich kein anderer Fleck feststellen, so stimmt die Auswertung des ersten Chromatogramms.
TABELLE II
Farben der Vergleichssubstanzen nach Chromatographie und Nachweis durch Joddämpfe
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138653
alte Dokumentnummer
N8199547960J
Zusatzdokumente: image001, image002, image003, image004, image005, image006, image007, image008, image009
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)